|
|
| (544 revisões intermediárias por 15 usuários não estão sendo mostradas) |
| Linha 1: |
Linha 1: |
| − | <span style="font-size:large;color:red">''Aos usuários do Siscomaj, esclarecemos que foram atualizados diversos medicamentos desde abril de 2016, dentre eles citamos os padronizados pelo Sistema Único de Saúde – SUS, pertencentes a Rename e os não padronizados, que foram incluídos de acordo com a necessidade. A data da atualização consta no final da página de cada medicamento, nutrição e procedimento. Portanto, salientamos que onde constam datas anteriores a abril de 2016, ainda não foram atualizadas. Salientamos também, que os medicamentos de uso hospitalar, fornecidos pelo estado, encontram-se em processo de atualização.''</span>
| + | =='''Conhecendo a plataforma'''== |
| | | | |
| | + | '''As informações sobre incorporações, padronizações, medicamentos, insumos e terapias disponíveis no SUS constam nesta plataforma de livre acesso.''' |
| | | | |
| − | <span style="font-size:large;color:red">''Núcleo de Apoio Técnico – NAT/SC''</span>
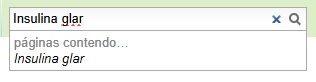
| + | Para melhor utilização, orienta-se que a busca deve ser feita com o nome exato do título da página (a busca diferencia letras maiúsculas de minúsculas). |
| | + | '''Exemplos:''' |
| | | | |
| | + | [[Arquivo:Insulina_glargina_sem_correspondente.jpg]] |
| | | | |
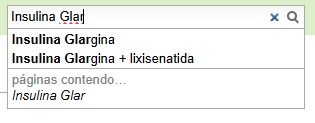
| | + | [[Arquivo:Insulina_glargina_com_correspondente.jpg]] |
| | + | |
| | + | E caso a procura seja pelo nome comercial do medicamento/insumo, digitar o nome desejado e apertar tecla ENTER, sem esperar que apareça campo correspondente pela pesquisa. '''Exemplo:''' |
| | | | |
| − | ==Medicamentos==
| + | [[Arquivo:Busca_nome_comercial_2.jpg]] |
| − | Índice (páginas já concluídas)
| |
| | | | |
| − | <table border="3" cellpadding="6">
| + | =='''Medicamentos'''== |
| − | <tr><th><font size=4>[[A]]</font></th><th><font size=4>[[B]]</font></th><th><font size=4>[[C]]</font></th><th><font size=4>[[D]]</font></th><th><font size=4>[[E]]</font></th><th><font size=4>[[F]]</font></th><th><font size=4>[[G]]</font></th><th><font size=4>[[H]]</font></th><th><font size=4>[[I]]</font></th><th><font size=4>[[J]]</font></th><th><font size=4>[[K]]</font></th><th><font size=4>[[L]]</font></th><th><font size=4>[[M]]</font></th><th><font size=4>[[N]]</font></th><th><font size=4>[[O]]</font></th><th><font size=4>[[P]]</font></th><th><font size=4>[[Q]]</font></th><th><font size=4>[[R]]</font></th><th><font size=4>[[S]]</font></th><th><font size=4>[[T]]</font></th><th><font size=4>[[U]]</font></th><th><font size=4>[[V]]</font></th><th><font size=4>[[W]]</font></th><th><font size=4>[[X]]</font></th><th><font size=4>[[Y]]</font></th><th><font size=4>[[Z]]</font></th><th><font size=4>[[Todos]]</font></th></tr>
| |
| | | | |
| − | </table>
| |
| | | | |
| − | =='''<span style="font-size:large;color:blue">''CONITEC''</span>'''== | + | <table border="3" cellpadding="10"> |
| | | | |
| − | *'''<span style="font-size:small;color:green"> [http://conitec.gov.br/images/Relatorios/Portaria/2017/PortariasSCTIE-09e10_2017.pdf Portaria nº 10, de 21 de fevereiro de 2017] - Torna pública a decisão de incorporar insulina análoga de ação rápida para o tratamento da Diabetes Mellitus Tipo 1, no âmbito do Sistema Único de Saúde - SUS.</span>'''
| + | <tr><th><font size=4>[[A]]</font></th><th><font size=4>[[B]]</font></th><th><font size=4>[[C]]</font></th><th><font size=4>[[D]]</font></th><th><font size=4>[[E]]</font></th><th><font size=4>[[F]]</font></th><th><font size=4>[[G]]</font></th><th><font size=4>[[H]]</font></th><th><font size=4>[[I]]</font></th><th><font size=4>[[J]]</font></th><th><font size=4>[[K]]</font></th><th><font size=4>[[L]]</font></th><th><font size=4>[[M]]</font></th><th><font size=4>[[N]]</font></th><th><font size=4>[[O]]</font></th><th><font size=4>[[P]]</font></th><th><font size=4>[[Q]]</font></th><th><font size=4>[[R]]</font></th><th><font size=4>[[S]]</font></th><th><font size=4>[[T]]</font></th><th><font size=4>[[U]]</font></th><th><font size=4>[[V]]</font></th><th><font size=4>[[W]]</font></th><th><font size=4>[[X]]</font></th><th><font size=4>[[Y]]</font></th><th><font size=4>[[Z]]</font></th> |
| | | | |
| | + | </table> |
| | | | |
| − | '''''Relatórios de recomendação'''''
| + | =='''Medicamentos por CID e PCDT'''== |
| − | | |
| − | *'''Relatório nº 249''' - [http://conitec.gov.br/images/Relatorios/2017/RELATORIO_Cirurgiabariatrica_laparoscopia_FINAL_249_2017.pdf Cirurgia bariátrica por laparoscopia] - '''Incorporar ao SUS''' - [http://conitec.gov.br/images/Relatorios/Portaria/2017/PortariaSCTIE_04a06_2017.pdf SCTIE/MS nº 05/2017] - Publicada em 01/02/2017
| |
| − | | |
| − | *'''Relatório nº 247''' - [http://conitec.gov.br/images/Relatorios/2017/RELATORIO_escleroterapia_FINAL_247_2017.pdf Tratamento esclerosante não estético de varizes de membros inferiores] - '''Incorporar ao SUS''' - [http://conitec.gov.br/images/Relatorios/Portaria/2017/PortariaSCTIE_04a06_2017.pdf SCTIE/MS nº 04/2017] - Publicada em 01/02/2017
| |
| − | | |
| − | *'''Relatório nº 241''' - [http://conitec.gov.br/images/Relatorios/2017/Relatorio_Tofacitinibe_AR_FINAL_241_2016.pdf Tofacitinibe para o tratamento de pacientes adultos com artrite reumatoide ativa moderada a grave com resposta inadequada a um ou mais medicamentos modificadores do curso da doença] - '''Incorporar ao SUS''' - [http://conitec.gov.br/images/Relatorios/Portaria/2017/PortariaSCTIE_08_2017.pdf SCTIE/MS nº 08/2017] - Publicada em 02/02/2017
| |
| − | | |
| − | *'''Relatório nº 242''' - [http://conitec.gov.br/images/Relatorios/2017/RELATORIO_Bevacizumabe_Cancer_ColodeUtero_FINAL_242_2017.pdf Bevacizumabe para o Tratamento de Câncer de Colo de Útero Persistente, Recorrente ou Metastático] - '''Não incorporar ao SUS''' - [http://conitec.gov.br/images/Relatorios/Portaria/2017/PortariaSCTIE_04a06_2017.pdf SCTIE/MS nº 06/2017] - Publicada em 01/02/2017
| |
| − | | |
| − | =='''<span style="font-size:large;color:red">''ALERTAS''</span>'''== | |
| − | | |
| − | '''1. SUS incorpora medicamento para artrite reumatoide
| |
| − | | |
| − | Pessoas com artrite reumatoide poderão contar com mais um medicamento para tratamento no Sistema Único de Saúde (SUS). A incorporação do citrato de tofacitinibe ao rol de medicamentos disponibilizados para a população foi realizada na quinta-feira (02/02) com a publicação no [http://conitec.gov.br/images/Relatorios/Portaria/2017/PortariaSCTIE_08_2017.pdf Diário Oficial da União]. O SUS tem até 180 dias para disponibilizar o medicamento a todo o país. A indicação do medicamento é direcionada a pacientes adultos com artrite reumatoide ativa, moderada a grave, com resposta inadequada a um ou mais medicamentos modificadores do curso da doença. A proposta de incorporação apresentada pela Conitec, responsável pela indicação de novas tecnologias ao SUS, avaliou a eficácia e segurança em comparação com as alternativas já contempladas, bem como com o impacto orçamentário gerado pela incorporação e com a experiência internacional na utilização desse medicamento.[http://www.conass.org.br/sus-incorpora-medicamento-para-artrite-reumatoide/ CONASS] Acesso em: 06/02/2017
| |
| − | | |
| − | | |
| − | '''2. Posicionamento da Sociedade Brasileira de Medicina Nuclear em relação aos custos do tratamento com [[Rádio, cloreto (223 Ra)]] (Xofigo®)
| |
| − | | |
| − | Atendendo a diversas solicitações de associados, a Sociedade Brasileira de Medicina Nuclear (SBMN), fez um estudo para estimar os custos envolvidos no Tratamento de Metástases Ósseas com [[Rádio, cloreto (223 Ra)]] (Xofigo®). Este estudo tem o objetivo de auxiliar os associados a efetuarem os próprios cálculos. O resultado do estudo da SBMN, que considerou os custos básicos de um serviço de Medicina Nuclear de porte médio, sugere para reembolso do Tratamento de Metástases Ósseas com [[Rádio, cloreto (223 Ra)]] (Xofigo®) o valor total de R$ 24.485,80 por aplicação (o tratamento completo inclui seis aplicações, dependendo da tolerância do paciente) que expressa o reembolso pela Saúde Suplementar referente a: (I) custos do material radioativo rádio-223 acrescido de impostos; (II) estrutura para o recebimento, guarda, manipulação, radioproteção e gerenciamento de rejeitos radioativos, de acordo com as normas, equipamentos e pessoal legalmente exigidos pela dupla regulamentação feita pela Comissão Nacional de Energia Nuclear (CNEN) e ANVISA; e (III) atuação e responsabilidade técnica e jurídica do Médico Nuclear obrigatoriamente titulado pela SBMN-AMB e CNEN, particularmente na: (1) consulta inicial para a correta seleção dos pacientes elegíveis para o tratamento; (2) avaliação e orientações iniciais; (3) consulta pré-tratamento; (4) definição da dose; (5) manipulação apropriada do material radioativo, recipientes e seringas antes, durante e após o procedimento; e (6) avaliação imediata do paciente pós tratamento. [http://sbmn.org.br/noticia/posicionamento-da-sbmn-em-relacao-aos-custos-do-tratamento-com-radio-223/ Sociedade Brasileira de Medicina Nuclear] Acesso em: 24/01/2017
| |
| − | | |
| − | | |
| − | '''3. Ministério da Saúde restringe acesso a alguns remédios do Farmácia Popular
| |
| − | | |
| − | O Ministério da Saúde restringiu o acesso a alguns remédios do programa Farmácia Popular. A partir de agora, só pessoas de determinadas faixas etárias poderão retirar medicamentos de doenças como dislipidemia (colesterol alto), osteoporose, mal de Parkinson e hipertensão. Além disso, idosos serão impedidos de comprar contraceptivos nos estabelecimentos credenciados. Segundo o ministério, o objetivo é evitar fraudes. Para dislipidemia, só a partir dos 35 anos será possível retirar remédios. No caso da osteoporose, a idade mínima é 40 anos. Mal de Parkinson só depois dos 50. Para hipertensão, é necessário ter completado 20 anos. No caso de contraceptivos, a idade vai de 10 a 59 anos. No caso de uma pessoa que tem uma das doenças em que houve restrição e está fora da faixa etária permitida, ela poderá ter acesso a tratamento e medicamentos nas unidades do Sistema Único de Saúde (SUS), mas não por meio do programa Farmácia Popular. [http://www.cff.org.br/noticia.php?id=4290&titulo=Minist%C3%A9rio+da+Sa%C3%BAde+restringe+acesso+a+alguns+rem%C3%A9dios+do+Farm%C3%A1cia+Popular Conselho Federal de Farmácia] Acesso em: 20/01/2017
| |
| − | | |
| − | | |
| − | '''4. Anvisa aprova 1º medicamento derivado da maconha
| |
| − | | |
| − | A Agência Nacional de Vigilância Sanitária (Anvisa) aprovou o primeiro medicamento com substâncias derivadas da maconha no Brasil. Registrado como Mevatyl, remédio já é vendido em 28 outros países, com o nome de Sativex. Ele é indicado para o controle de sintomas da esclerose múltipla em pacientes que não respondem a outros tratamentos. O remédio não é recomendado para menores de 18 anos. A restrição é reflexo da falta de estudos que demonstrem a segurança e a eficácia do medicamento em crianças e adolescentes. De acordo com a Anvisa, ele não é indicado para o tratamento da epilepsia. Isso porque o medicamento leva em sua composição o THC, um derivado da maconha que tem o potencial de agravar crises da doença. O preço ainda não está definido. A expectativa é de que chegue ao mercado até o fim do semestre. A venda só será feita mediante uma receita de controle especial. Além de THC (tetraidrocanabinol), o remédio traz canabidiol (CBD). Ambos são obtidos a partir da maconha. O produto será vendido em solução oral (spray). [http://crfsc.gov.br/anvisa-aprova-1o-medicamento-derivado-da-maconha/ Conselho Regional de Farmácia de SC] Acesso em: 20/01/2017
| |
| − | | |
| − | | |
| − | '''5. Saúde inclui novos procedimentos no rol de práticas integrativas
| |
| − | | |
| − | Os serviços de saúde locais poderão oferecer mais tratamentos classificados como práticas integrativas e complementares (PICs) utilizando recursos federais. Foram incluídos, nesta semana, novos procedimentos na lista de práticas integrativas do Sistema Único de Saúde (SUS), que abrange recursos terapêuticos baseados em conhecimentos tradicionais. São sete novos tratamentos: sessão de arteterapia, sessão de meditação, sessão de musicoterapia, tratamento naturopático, sessão de tratamento osteopático, sessão de tratamento quiroprático e sessão de REIKI. A inclusão foi realizada por meio da [http://www.editoramagister.com/legis_27275941_PORTARIA_N_145_DE_11_DE_JANEIRO_DE_2017.aspx Portaria N° 145/2017], publicada no Diário Oficial da União.[http://portalsaude.saude.gov.br/index.php/cidadao/principal/agencia-saude/27340-saude-passa-a-oferecer-arteterapia-meditacao-e-musicoterapia-a-populacao Ministério da Saúde] Acesso em: 19/01/2017
| |
| − | | |
| − | | |
| − | '''6. Publicado o 3º Alerta de MHT do medicamento Mipomersen para o tratamento da Hipercolestorelemia pela Conitec
| |
| − | | |
| − | O [http://conitec.gov.br/images/Artigos_Publicacoes/Radar/alerta_MHT_03_Mipomersen_FINAL_MS.pdf 3º Alerta de Monitoramento do Horizonte Tecnológico (MHT)] do Departamento de Gestão e Incorporação de Tecnologias em Saúde (DGITS/SCTIE) aborda o medicamento Mipomersen (Kynamro®) para o tratamento da Hipercolestorelemia Familia Homozigótica.Este alerta é um dos volumes do periódico [http://conitec.gov.br/index.php/monitoramento-de-tecnologias Alertas de Monitoramento do Horizonte Tecnológico] do DGITS. Essa publicação tem caráter científico e acesso livre. É elaborado com base nas melhores evidências científicas disponíveis e tem como objetivo informar a sociedade quanto aos potenciais impactos de tecnologias novas (em fase de aprovação ou recém aprovadas por agências reguladoras) e emergentes (em estágio de desenvolvimento) no cuidado aos pacientes, no sistema de saúde e na organização dos serviços.[http://conitec.gov.br/publicado-o-3-alerta-de-monitoramento-do-horizonte-tecnologico-do-medicamento-mipomersen-kynamro-para-o-tratamento-da-hipercolestorelemia-familia-homozigotica Alerta de Monitoramento do Horizonte Tecnológico (MHT) do Departamento de Gestão e Incorporação de Tecnologias em Saúde (DGITS/SCTIE)] Acesso em: 11/01/2017
| |
| − | | |
| − | | |
| − | '''7. Medicamento para tratamento da Doença de Crohn fará parte do rol de medicamentos ofertados pelo SUS
| |
| − | | |
| − | A Secretaria de Ciência e Tecnologia e Insumos Estratégicos do Ministério da Saúde, SCTIE/MS, publicou em 05/01/17, no Diário Oficial da União (DOU), na seção 01, a portaria que trata da decisão de incorporar o '''[[certolizumabe pegol]] para o tratamento da Doença de Crohn moderada a grave''', conforme Protocolo Clínico e Diretrizes Terapêuticas do Ministério da Saúde (PCDT), no âmbito do Sistema Único de Saúde – SUS. De acordo com o Decreto nº 7.646/2011, a partir da publicação da decisão de incorporar uma tecnologia em saúde, há um prazo máximo de 180 dias para que seja efetivada a sua oferta aos pacientes do SUS.[http://conitec.gov.br/ultimas-noticias-3/16671-medicamento-para-tratamento-da-doenca-de-crohn-fara-parte-do-rol-de-medicamentos-ofertados-pelo-sus CONITEC] Acesso em: 09/01/2017
| |
| − | | |
| − | ==Informações==
| |
| − | | |
| − | - [[Acesso ao Componente Especializado da Assistência Farmacêutica - CEAF]]
| |
| − | | |
| − | - [[Antídotos]] - <span style="font-size:large;color:red">''Novo!''</span>
| |
| − | | |
| − | - [[Ausência de Registro na ANVISA]]
| |
| − | | |
| − | - [[Comissão Intergestores Bipartite CIB]]
| |
| − | | |
| − | - [[CONITEC]]
| |
| − | | |
| − | - [[Guia Entendendo a Incorporação de Tecnologias em Saúde no SUS – Como se Envolver]] <span style="font-size:large;color:red">''Novo!''</span>
| |
| − | | |
| − | - [[ Endereços/Contatos CACON/UNACONs ]]
| |
| − | | |
| − | - [[ Medicamentos - Conceitos e Informações Técnicas]]
| |
| − | | |
| − | - [[Medicamentos de Combate a AIDS e ao HIV - Antirretrovirais (ARV)]]
| |
| − | | |
| − | - [[Medicamentos Manipulados]]
| |
| − | | |
| − | - [[ Medicamento "off label"]]
| |
| − | | |
| − | - [[ Prescrições Médicas ]]
| |
| − | | |
| − | - [[RENAME]]
| |
| − | | |
| − | - [[Tratamento oncológico no SUS]]
| |
| − | | |
| − | ==Programas==
| |
| − | | |
| − | - [[Programa Estadual de Vigilância e Controle das Hepatites Virais (PEHV)]]
| |
| − | | |
| − | - [[Programa Farmácia Popular do Brasil]]
| |
| − | | |
| − | - [[Componente Estratégico da Assistência Farmacêutica (CESAF)]]
| |
| − | | |
| − | - [[Componente Estratégico da Assistência Farmacêutica (CESAF) - Hanseníase]]
| |
| − | | |
| − | - [[Componente Estratégico da Assistência Farmacêutica (CESAF) - Tracoma]]
| |
| − | | |
| − | - [[Componente Estratégico da Assistência Farmacêutica (CESAF) - Tabagismo]]
| |
| − | | |
| − | - [[Componente Estratégico da Assistência Farmacêutica (CESAF) - Tuberculose]]
| |
| − | | |
| − | - [[Componente Especializado da Assistência Farmacêutica (CEAF)]]
| |
| − | | |
| − | ==Legislação==
| |
| − | | |
| − | - [http://bvsms.saude.gov.br/bvs/saudelegis/gm/2013/prt0874_16_05_2013.html Política Nacional para a Prevenção e Controle do Câncer]
| |
| − | | |
| − | ==Links Úteis==
| |
| − | -
| |
| − | [http://portalses.saude.sc.gov.br/index.php?option=com_docman&task=doc_download&gid=7659&Itemid=128 Deliberação 501/CIB/13 de 27 de novembro de 2013]
| |
| − | | |
| − | - [http://cgj.tjsc.jus.br/saude/index.htm Portal Assistência à Saúde], da Corregedoria-Geral da Justiça/SC
| |
| − | | |
| − | - [http://rebrats.saude.gov.br/ Rede Brasileira de Avaliação de Tecnologias em Saúde (REBRATS)]
| |
| | | | |
| − | - [http://portalsaude.saude.gov.br/index.php?option=com_content&view=article&id=11635&Itemid=702 Componente Especializado da Assistência Farmacêutica] | + | '''Um novo recurso está disponível no site da CONITEC:''' o '''painel interativo de Medicamentos por CID e Protocolos Clínicos e Diretrizes Terapêuticas (PCDT)''' possibilita uma consulta rápida dos medicamentos e dos códigos da Classificação Internacional de Doenças (CID-10) contemplados nas diretrizes do Ministério da Saúde. |
| | | | |
| − | - [http://portalsaude.saude.gov.br/index.php/o-ministerio/principal/leia-mais-o-ministerio/840-sctie-raiz/daf-raiz/cgceaf-raiz/cgceaf/l3-cgceaf/11646-pcdt Protocolos Clínicos E Diretrizes Terapêuticas (PCDT)], do Ministério Da Saúde
| + | '''Obs:''' ''a ferramenta não substitui a leitura integral do documento, uma vez que a indicação de cada medicamento exige atenção a critérios adicionais, como idade do paciente, histórico de tratamentos, estágio da doença, entre outros.'' |
| | | | |
| − | - [http://www.projetodiretrizes.org.br/ Projeto Diretrizes - CFM AMB ANS]
| + | <span style="color:blue">[https://www.gov.br/conitec/pt-br/protocolos-clinicos-e-diretrizes-terapeuticas/medicamentos-por-cid-e-pcdt '''Clique aqui'''] '''para acessar o painel.''' |
| | | | |
| − | - [http://portalsaude.saude.gov.br/index.php/o-ministerio/principal/secretarias/sctie/conitec Comissão Nacional de Incorporação de Tecnologias no SUS (CONITEC)]
| + | =='''Recomendações avaliadas pela CONITEC'''== |
| | | | |
| − | - [http://portalsaude.saude.gov.br/index.php/o-ministerio/principal/leia-mais-o-ministerio/840-sctie-raiz/daf-raiz/cgceaf-raiz/cgceaf/l3-cgceaf/11647-consulta-publica Consultas Públicas De Protocolos Clínicos E Diretrizes Terapêuticas]
| + | *[[Medicamentos incorporados - 2026]] |
| | | | |
| − | - [http://www.ncbi.nlm.nih.gov/pubmed/ PubMed (artigos científicos da área da saúde)] | + | *[[Medicamentos incorporados - 2025]] |
| | | | |
| − | - [http://www.scielo.br/?lng=pt SciELO (biblioteca eletrônica de periódicos científicos brasileiros)] | + | *[[Medicamentos incorporados - 2024]] |
| | | | |
| − | - [http://bvsalud.org/ Biblioteca Virtual em Saúde] | + | *[[Medicamentos incorporados - 2023]] |
| | | | |
| − | - [http://portal2.saude.gov.br/saudelegis/LEG_NORMA_PESQ_CONSULTA.CFM Saúde Legis] | + | *[[Medicamentos incorporados - 2022]] |
| | | | |
| − | - [http://scholar.google.com.br/schhp?sourceid=navclient&ie=UTF-8&hl=pt-BR Google acadêmico]
| + | *[[Medicamentos incorporados - 2021]] |
| | | | |
| − | - [http://www7.anvisa.gov.br/datavisa/Consulta_Produto/consulta_medicamento.asp Consulta de registro do medicamento na ANVISA] | + | *[[Medicamentos incorporados - 2020]] |
| | | | |
| − | ==Residual==
| + | *[[Medicamentos incorporados - 2019]] |
| | | | |
| − | - [[Alergia à proteína do leite de vaca]]
| + | *[[Procedimentos, exames e insumos incorporados - 2026]] |
| | | | |
| − | - Artroplastia de quadril/[[Prótese (de quadril)]]
| + | *[[Procedimentos, exames e insumos incorporados - 2025]] |
| | | | |
| − | - [[Cross-linking]] (cirurgia para ceratocone)
| + | *[[Procedimentos, exames e insumos incorporados - 2024]] |
| | | | |
| − | - [[Curativos]]
| + | *[[Procedimentos, exames e insumos incorporados - 2023]] |
| | | | |
| − | - [[DMRI|Degeneração Macular Relacionada à Idade (DMRI)]]
| + | *[[Procedimentos, exames e insumos incorporados - 2022]] |
| | | | |
| − | - [[Eletroconvulsoterapia]]
| + | *[[Procedimentos, exames e insumos incorporados - 2021]] |
| | | | |
| − | - [[Internação Psiquiátrica Compulsória]]
| + | *[[Procedimentos, exames e insumos incorporados - 2020]] |
| | | | |
| − | - [[Intolerância à lactose]]
| + | *[[Procedimentos, exames e insumos incorporados - 2019]] |
| | | | |
| − | - [[Litíase urinária]] (pedras nos rins, ureteres ou bexiga)
| + | =='''Componentes da Assistência Farmacêutica'''== |
| | | | |
| − | - [[Meia Elástica]]
| + | *[[Componente Básico da Assistência Farmacêutica - CBAF]] |
| | | | |
| − | - [[Método Bobath]]
| + | *[[Componente Especializado da Assistência Farmacêutica - CEAF]] |
| | | | |
| − | - [[Método Pediasuit]] <span style="font-size:large;color:blue">''Em Atualização''</span>
| + | *[[Componente Estratégico da Assistência Farmacêutica - CESAF]] |
| | | | |
| − | - [[Monitorização Neurofisiológica Intraoperatória]]
| + | *[[Tratamento oncológico no SUS|Componente da Assistência Farmacêutica em Oncologia - AF-Onco]] |
| | | | |
| − | - [[Óculos]]
| + | =='''Residual'''== |
| | | | |
| − | - [[Oxigenoterapia Domiciliar]]
| + | *[[Doenças]] |
| | | | |
| − | - [[Oxigenoterapia Hiperbárica]]
| + | *[[Nutrição]] |
| | | | |
| − | - [[Pet-Scan]]
| + | *[[Procedimentos Médicos Terapêuticos]] |
| | | | |
| − | - [[Quimioterapia Intraperitoneal Hipertérmica]]
| + | *[[Procedimentos Médicos Diagnósticos|Procedimentos Médicos Diagnósticos - Exames Complementares]] |
| | | | |
| − | - [[Stent Farmacológico]]
| + | *[[Produtos para saúde (insumos)|Produtos para saúde - Insumos]] |
| | | | |
| − | - [[Videoartroscopia]]
| + | *[[Terapias Complementares]] |
| | | | |
| − | ==Colaboradores==
| + | *[[Pedido de internação / asilamento]] |
| | | | |
| − | Contribuíram para atualização do banco de dados do SISCOMAJ:
| + | *[[Prontuário e Documentos Médicos]] |
| | | | |
| − | - Diretoria de Assistência Farmacêutica (DIAF)
| + | *[[Prerrogativas Médicas]] |
| | | | |
| − | - Diretoria de Vigilância Epidemiológica (DIVE) | + | *[[Tratamento Fora do Domicílio - TFD]] |
| | | | |
| − | - Diretoria de Vigilância Sanitária Estadual
| + | *[[Implante Dentário]] |
| | | | |
| − | '''Término da gestão do SISCOMAJ/COMAJ em março/2016'''
| + | * [[Recomendações do COMESC]] |